GLP-1 receptor agonisten hebben naast het verlagen van glucose een aantal bijkomende voordelen. De middelen hebben een laag risico op hypoglykemieën, verlagen het lichaamsgewicht, verbeteren het lipidenspectrum, reduceren de bloeddruk en – niet onbelangrijk in een tijd waarin de diabeteszorg zich steeds meer richt op cardiovasculaire preventie – bieden cardiovasculaire bescherming tegen met name de atherosclerotisch gerelateerde cardiovasculaire aandoeningen. Ze hebben ook nadelen; GLP-1 receptor agonisten zijn duur en hun toedieningsvorm en bijwerkingenprofiel leiden tot een verminderde acceptatie en compliance. Concreet leidt het ertoe dat de middelen met name in patiënten met gevorderde diabetes als optie worden overwogen.
De orale variant van GLP-1 receptor agonist semaglutide zou één deze van deze barrières weg kunnen nemen. Deze variant is net als subcutaan semaglutide een humaan GLP-1 analoog, maar dan in co-formulering met een gemoduleerde vrije vetzuurketen die de absorptie in het gastrisch epitheel bevordert en proteolyse in het zure milieu van de maag tegengaat. Op de afgelopen ADA werden de resultaten van het PIONEER programma met semaglutide oraal besproken.
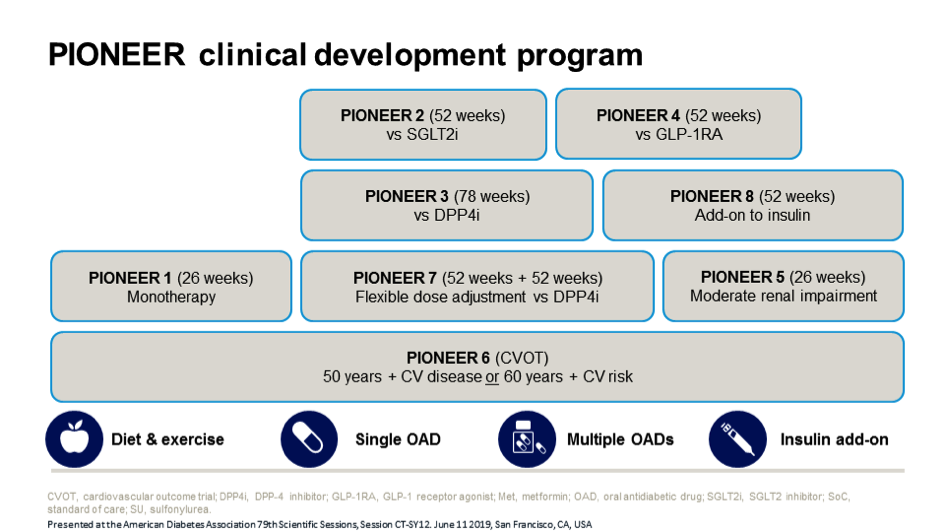
Allereerst werden de resultaten van de placebo-gecontroleerde fase III studies PIONEER 1, 5 en 8 getoond. In de 3 studies gaf oraal semaglutide significante reducties in HbA1c welke afhankelijk van de dosering opliepen van 0,6 tot 1,5%. Ondanks de verschillen in populatie en achtergrondmedicatie (zie figuur 1) bleek de werkzaamheid van semaglutide niet tot nauwelijks te verschillen tussen de studies. Het verlies van lichaamsgewicht lag in de studies in de orde van 1,3 kg tot gemiddeld 4,7 kg in de hoogste 14 mg dosering. Het bijwerkingenprofiel was vergelijkbaar met andere GLP-1 receptor agonisten, met overwegend meer gastro-intestinale bijwerkingen het gebruik van oraal semaglutide, met name in de 14 mg dosering tot wel 50,3% in PIONEER 8, wat vaker leidde tot het staken van het studiemedicijn.
PIONEER 2, 3, 4 & 7 lieten zien hoe oraal semaglutide zich staande houdt ten opzichte van alternatieven zoals de SGLT2 remmer empagliflozine 25 mg (PIONEER 2), de DPP-4 remmer sitagliptine 100 mg (PIONEER 3 en 7) en de subcutane GLP-1 receptor agonist liraglutide 1,8 mg (PIONEER 4). Oraal semaglutide bleek in de hogere dosering van 14 mg glykemisch iets sterker te werken dan empagliflozine (HbA1c-verschil 0.4%) en sitagliptine (HbA1c-verschil 0.5%) en gelijkwaardig te zijn aan liraglutide. De reductie in lichaamsgewicht was groter dan met sitagliptine (2,5 kg) of liraglutide (0,5 kg) maar vergelijkbaar met de reductie van empagliflozine. Er was geen verschil in het optreden van hypoglykemieën tussen de verschillende middelen. Het totaal aantal ongunstige bijwerkingen verschilde niet van empagliflozine, sitagliptine of liraglutide. Logischerwijs kwamen er meer gastro-intestinale bijwerkingen voor ten opzichte van empagliflozine en sitagliptine.
In PIONEER 6 werden de cardiovasculaire uitkomsten van oraal semaglutide 14 mg versus placebo onderzocht in 3183 patiënten met type 2 diabetes (leeftijd 66 jaar; 68% man; HbA1c 8,2%; diabetesduur 15 jaar; BMI 32 kg/m2). Van de geïncludeerde patiënten had 85% een leeftijd ≥50 jaar met cardiovasculaire voorgeschiedenis en 15% een leeftijd van ≥60 jaar met de aanwezigheid van cardiovasculaire risicofactoren.
Oraal semaglutide was cardiovasculair niet-inferieur aan placebo, maar wist ook geen superioriteit aan te tonen. De primaire samengestelde cardiovasculaire uitkomstmaat (MACE) bestaande uit niet-fataal myocardinfarct, niet-fatale beroerte en cardiovasculaire sterfte toonde een niet-significante daling van 21% in gedurende een mediane follow-up van 15,9 maanden (HR 0,79; 95% BI 0,57 tot 1,11). De reductie in MACE in PIONEER 6 werd met name veroorzaakt door een reductie in cardiovasculaire sterfte van 51% (HR 0,49; 95% BI 0,27 tot 0,92) met n=15 tegen n=30 events. Niet-fataal myocardinfarct bleef statistisch gelijk (HR 1,18; 95% BI 0,73 tot 1,90) met n=37 tegen n=31 events, terwijl niet-fatale beroerte een 26% reductie toonde (HR 0,74; 95% BI 0,35 tot 1,57) met n=16 tegen n=12 events. De algehele sterfte was met semaglutide ook lager gedurende de studie (HR 0,51; 95% BI 0,31 tot 0,84) met n=23 tegen n=45 events.
Gedurende de studie ontstond een klein glykemisch verschil tussen beide studiegroepen. Het HbA1c daalde vanaf baseline met gemiddeld 1,0% aan het einde van de studie door semaglutide, en 0,3% met placebo. Het lichaamsgewicht nam gedurende de studie met gemiddeld 4,2 kg af met semaglutide en 0,8 kg met placebo. Ongunstige bijwerkingen waren min of meer gelijk verdeeld over beide groepen, behalve gastro-intestinale bijwerkingen zoals misselijkheid, braken en diarree welke meer voorkwamen in de semaglutide groep. Dit leidde vaker tot het stopzetten van de studiemedicatie dan in de placebogroep.
Het verschil tussen PIONEER 6 en de reeds eerder uitgevoerde cardiovasculaire veiligheidsstudies die wel cardiovasculaire superioriteit wisten aan te tonen is aanzienlijk; LEADER (liraglutide), SUSTAIN-6 (semaglutide), en zeer recentelijk REWIND (dulaglutide) hadden een beduidend langere follow-up dan PIONEER 6, terwijl HARMONY (albiglutide) een populatie includeerde die ongeveer 3 keer zo groot was als die van PIONEER 6, resulterend in een hogere aantallen events in deze studies. Met dit in het achterhoofd kan men concluderen dat PIONEER 6 wel indicaties levert die nogmaals aangeven dat GLP-1 receptor agonisten cardiovasculair voordeel bieden, maar gezien de grootte van de populatie en korte follow-up gewoonweg niet genoeg power heeft om dit statistisch aan te tonen.
De gelijkenis in hazard ratio met SUSTAIN-6 biedt in ieder geval geen reden om aan te nemen dat de toedieningsvorm gevolg heeft voor het cardiovasculair effect dat semaglutide bewerkstelligd. Oraal semaglutide voorziet hiermee in de behoefte naar een patiëntvriendelijk en gelijkwaardig alternatief voor de subcutane GLP-1 receptor agonisten. Hierdoor blijft de klasse van GLP-1 receptor agonisten niet langer enkel voorbestemd voor de patiënt met vergevorderde type 2 diabetes, maar wordt gebruik met eerder genoemde bijkomende voordelen ook toegankelijker voor patiënten in een vroeger ziektestadium.