Soms is men op zoek naar iets simpels en dan vindt men iets heel anders, maar wel iets wat heel bruikbaar is. Dat wordt wel serendipiteit genoemd. Bij SGLT-2 remmers was het simpele doel: verlaging van de bloedsuiker en hopelijk gewichtsverlies. En ja, dat werkte. Maar SGLT-2 remmers bleken ook bescherming tegen hartfalen en daarnaast cardiovasculaire en renale bescherming te geven. Dus niet één, maar zelfs diverse onverwachte effecten. Hieronder treft u een samenvatting aan van het bewijs voor deze beschermende effecten en een analyse van de veronderstelde mechanismen. Het artikel is een samenvatting van een lijvig stuk van P Sarafidis et al. in Nephrol Dial Transplant 2019; 34: 208-230.
In 2015 (empagliflozine), 2017 (canagliflozine) en 2019 (dapagliflozine) verschenen ‘landmark trials’ waarvan de primaire eindpunten en secundaire eindpunten zijn samengevat in tabel 1. DBGK heeft eerder over deze studies gerapporteerd (klik hier (EMPA-REG vs CANVAS) en (DECLARE) voor de artikelen). Hierna verscheen in 2019 een ‘landmark trial’ gericht op voorkomen van progressie van nierziekte bij DM2 (CREDENCE).
Tabel 1. Eindpunten van landmark trials met hazard ratios van SGLT-2 remmers versus placebo (* = significant)
| STUDIE, jaar |
EMPA-REG, ‘15 |
CANVAS, ‘17
CANVAS-R ‘17 |
DECLARE-TIMI, ‘19 | META analyse | CREDENCE’19 |
| DUUR | 3,1 | 3,6 (5,5 & 2,1) | 4,2 | nvt | 2,6 |
| AANTAL | 7028 | 10142 | 17160 | 34322 | 4401 |
| CVD/at risk | 100 % | 59 %/41 % | 50 %/50 % | ||
| Leeftijd | 64 | 63 | 64 | 63 | |
| GFR | 74 | 76 | 85 | 56 | |
| MACE-3 | 0,86 * | 0,86 | 0,93 | 0,89 * # | 0,80 * |
| -CV† | 0,62 * | 0,87 | 0,98 | 0,78 | |
| -Nonfatal AMI | 0,87 | 0,85 | 0,89 | ||
| -Stroke | 1,23 | 0,90 | 1,01 | ||
| Totale † | 0,68 * | 0,87 | 0,98 | 0,83 | |
| Hartfalen Opname | 0,65 * | 0,67 * | 0,73 * | 0,70 * | 0,61 * |
| Progressie
Nierfalen $ |
1,5 vs 2,6 %
0,54 * |
5,3 vs 8,5 % 0,60 * | 1,5 vs 2,8 %
0,53 * |
0,55 * | 10 vs 15 %
0,66 * |
| ΔRR ( mm Hg) | -4/-1 | -4/-1,4 | -4/-1 | -3,3/-1,0 | |
| ΔGewicht ( kg) | -1,5 | -1,6 | -2 | -0,8 | |
| Δ HbA1c | -5 | -6 | -4 | -2,5 |
$ verdubbeling creat, eindstadium nierfalen of renaal overlijden
# alleen in degenen met bewezen atherosclerotisch vaatlijden (HR 0,86 *)
Waar vrijwel alle andere glucose verlagende middelen geen daling van cardiovasculaire complicaties lieten zien (alleen metformine in de UKPDS en in 2 kleine andere studies) laten GLP-1 receptor agonisten en SGLT-2 remmers een duidelijke daling zien van cardiovasculaire eindpunten. Daarnaast laten SGLT-2 remmers consequent een vertraging zien van nierfunctieverlies, gemeten aan harde klinische eindpunten en ook een consequente vermindering van opnames voor hartfalen (tabel 1).
Wat zijn nu de mogelijke mechanismen?
Ten opzichte van ACE-remmers en ARB’s is de vermindering van harde renale eindpunten (verdubbeling creatinine, eindstadium nierfalen of renale dood) indrukwekkend: 45 % daling versus 16 % bij losartan (RENAAL-studie), 20 % bij irbesartan (IDNT-studie).
Het nier-beschermend effect houdt ook aan na staken van de medicatie: 5 weken na staken van empagliflozine in de EMPA-REG studie was er nog steeds een reductie van albumine-excretie van 22-29 % waarneembaar in de empa-groep.
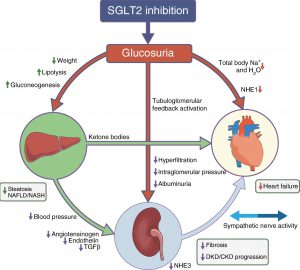
Het meest genoemde mechanisme van nefroprotectie is toename van tubuloglomerulaire feedback (Zie figuur 1): door remming van terugresorptie van natrium gekoppeld aan glucose in de proximale tubulus stijgt het aanbod natriumchloride aan de macula densa/juxtaglomerulaire apparaat. Dit leidt tot vasoconstrictie van de aanvoerende arteriole van de glomerulus; de filtratiefractie blijft gelijk, maar door verlaging van de bloeddoorstroming van de nier daalt de GFR en daarmee het aanbod natriumchloride aan de macula densa. Het evenwicht is weer hersteld.
Figuur 1 Mechanisme van herstel van tubuloglomerulaire feedback door SGLT-2 remmers bij DM 2
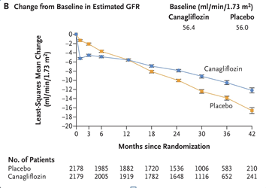
Dit ziet men in vivo door een initiële daling van de GFR in de eerste weken van de behandeling met een SGLT-2 remmer, net zoals men dat ziet in de initiële weken bij de behandeling met een RAAS remmer (echter, daar ontstaat de afgenomen GFR door postglomerulaire vasodilatatie waardoor de filtratiefractie afneemt), zie figuur 2.
Figuur 2: initiële daling GFR, gevolgd door minder steile daling nierfunctie
Het feit dat de albumine-excretie 5 weken na staken medicatie nog steeds lager is bij degenen die een SGLT-2 remmer hadden gebruikt en ook de jarenlange vermindering van daling van GFR suggereren dat er naast een hemodynamisch effect op TGF nog andere, meer blijvende factoren een rol spelen. De daling van bloeddruk is klein, maar kan zeker bijdragen aan nefroprotectie. Ook dalingen van HbA1c, alhoewel beperkt (gemiddeld -5 mmol/mol over de looptijd van de studies), en gewichtsdaling (gemiddeld 1-2 kg) zouden op langere termijn kunnen bijdragen.
Men ziet in vrijwel alle gevallen van diabetische nierschade bij ook fibrose en glomerulosclerose in het biopt. Steeds meer is komen vast te staan dat onder andere ‘Transforming Growth Factor 1-beta’ (TGF 1-beta) leidt tot de irreversibele veranderingen van fibrose en glomerulosclerose. Hyperglycemie, hypoxie zijn stimulatoren van TGF 1-beta productie. Via TGF 1-beta kunnen epitheelcellen in de nier transformeren tot mesenchymale cellen, voorlopercellen van bindweefsel en ook onder invloed van TGF 1 –beta wordt de productie van collageen gestimuleerd. Dit geldt overigens niet alleen voor de nier, maar ook voor het hart. SGLT-2 remmers blijken in diermodellen de effecten van TGF1-beta te antagoneren.
Daarnaast ziet men bij gebruik van SGLT-2 remmers een iets hoger Hb, enerzijds door het diuretisch effect en anderzijds door stimulering van de productie van erythropoietine door de nier.
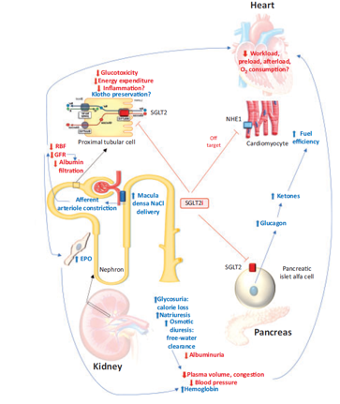
Figuur 3 Mechanismen van nefro- en cardioprotectie
Verklaringen voor minder opnames voor hartfalen
Door de bovengenoemde vasoconstrictie van de afferente arteriole naar de glomerulus daalt de renale bloeddoorstroming, waardoor de belasting voor het hart afneemt (de nieren zijn goed voor 20-25 % van het hartminutenvolume). Het hogere Hb door de hierboven genoemde stijging van erythropoietine draagt bij tot betere weefseloxygenatie en een verminderde behoefte tot verhoging van hartminutenvolume. Het diuretisch effect van SGLT-2 remmers is meer interstitieel dan intravasculair, waardoor de diurese niet ten koste gaat van verminderde intravasculaire vulling (preload). Een direct remmend effect van SGLT-2 remmers op de Na/H exporter kanaal in cardiomyocyten zou leiden tot minder apoptose van hartcellen en daarmee meer behoud van functie (dit is alleen dierexperimenteel aangetoond en in deep learning modellen).
SGLT-2 remmers stimuleren alfa cellen van het pancreas om glucagon af te geven; dit leidt tot een andere insuline/glucagon ratio en daarmee een grotere kans op het ontwikkelen van een diabetische keto-acidose (2-11x zo hoog). Maar voor het hart betekenen de hogere concentraties van ketonen extra brandstof, waardoor het hart efficiënter kan functioneren (meer ATP per molecuul verbrande brandstof).
Inmiddels is in 2019 in de NEJM ook de DAPA-HF studie gepubliceerd, waarbij 4744 patiënten met hartfalen NYHA klasse II, III of IV en een ejectiefractie < 40 % gerandomiseerd werden naar dapagliflozine of placebo. Deze studie bevestigde de verminderde behoefte aan opname voor hartfalen (RR 0.70, CI, 0.59 to 0.83). Ook cardiovasculaire sterfte was lager (RR 0.82; CI 0.69-0.92) en totale sterfte (RR 0.83, CI 0.71-0.97). 58 % van de patiënten had geen diabetes mellitus en in deze groep waren de effecten hetzelfde als in de groep met diabetes mellitus.
Tot slot: wie had destijds bij de wat moeizame introductie van SGLT-2 remmers (immers, er waren hinderlijke bijwerkingen en er klonken veel twijfels bij dokters) kunnen denken dat er zoveel onverwachte gunstige effecten zouden worden gevonden? En dat SGLT-2 remmers ook effectief zouden blijken bij hartfalen en nierfunctiestoornissen zonder diabetes? Wij niet. En daarom: inderdaad, serendipiteit in het kwadraat.
Referenties:
- SGLT-2 inhibitors and GLP-1 receptor antagonists for nephroprotection and cardioprotection in patients with diabetes mellitus and chronic kidney disease. A consensus statement by the EURECA-m and the DIABESITY working groups of the ERA-EDTA. P Safrafadis et al.; Nephrol Dial Transplant (2019); 34:208-230
- SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. TA Zelniker et al. 2019 Jan 5;393(10166):31-39.
- Unravelling the molecular mechanism of action of empagliflozin in heart failure with reduced ejection fraction with or without diabetes. O Iborra-Egea et al., JACC Basic Translat Sci 2019;4: 831-840
- Dapagliflozin in patients with heart failure and reduced ejection fraction . JJV McMurray et al. NEJM 2019; 381:1996-2008


1 reactie
Leuke samenvatting! Kleine aanvulling mbt het veronderstelde belangrijkste nefroprotectieve mechanisme: de activate van tubuloglomerulaire feedback en afferente vasocontrictie is alleen gevonden bij patiënten met T1D, terwijl de outcome trials met T2D patiënten zijn uitgevoerd en het SGLT2 remmers ook vrijwel alleen in deze populatie worden gebruikt.
Wij hebben recent aangetoond dat er weliswaar ook sprake lijkt van tubuloglomerulaire feedback activatie bij T2D patiënten, maar dat de daarop volgende afname in GFR berust op efferente vasodilatatie ipv afferente vasoconstrictie (Kidney Int. 2020 Jan;97(1):202-212.)